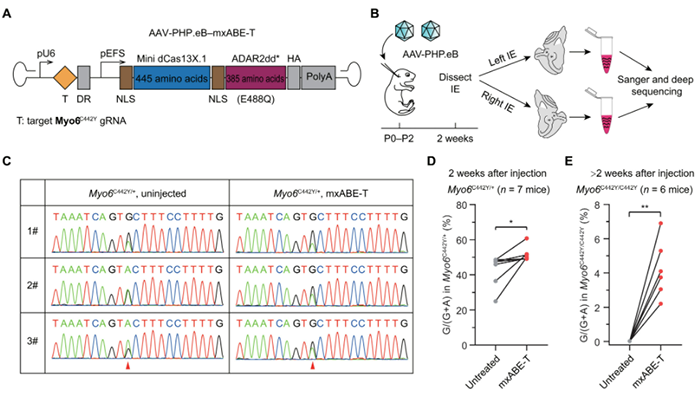
可编程 RNA 编辑工具能够对突变转录本进行可逆校正,从而降低与使用 DNA 编辑工具相关的永久性遗传变化相关的潜在风险。然而,这些 RNA 工具治疗疾病的潜力仍然未知。
2022年7月20日,复旦大学舒易来,李华伟及中国科学院脑科学与智能技术卓越创新中心杨辉共同通讯在Science Translational Medicine 在线发表题为“Rescue of autosomal dominant hearing loss by in vivo delivery of mini dCas13X-derived RNA base editor”的研究论文,该研究在肌球蛋白 VI p.C442Y 杂合突变 (Myo6C442Y/+ ) 小鼠模型(该模型概括了人类显性遗传性耳聋的表型)中使用基于 Cas13 的 RNA 碱基编辑器评估了 RNA 校正疗法。该研究首先在培养细胞中筛选了几种基于 Cas13 的 RNA 碱基编辑器和靶向 Myo6C442Y 的引导 RNA (gRNA),发现基于迷你 dCas13X.1 的腺苷碱基编辑器 (mxABE)[由截短的 Cas13X.1 和作用于 RNA 2 脱氨酶结构域变体 (ADAR2ddE488Q) 的 RNA 编辑酶腺苷脱氨酶组成],表现出高效率的 A > G 转换和低频率的脱靶编辑。
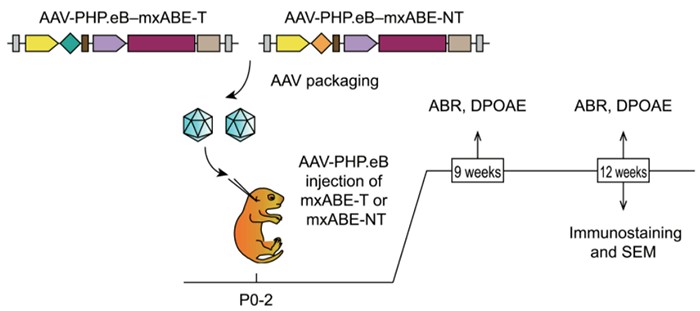
单个腺相关病毒 (AAV) 介导的 mxABE在耳蜗中的递送将突变的 Myo6C442Y 等位基因纠正为 Myo6WT (Myo6C442Y/C442Y)等位基因,并导致 Myo6C442Y/+ 小鼠的注射耳蜗中的 Myo6WT 等位基因增加。在向 Myo6C442Y/+ 小鼠注射 AAV-mxABE-Myo6 后长达 3 个月,该治疗挽救了听觉功能,包括听觉脑干反应等。该研究还观察到与未处理的对照耳相比,处理后的毛细胞存活率增加,毛束形态退化减少。总之,该研究结果支持将RNA 编辑治疗策略用于半显性疾病和潜在的隐性疾病。

定点 RNA 编辑技术通过引导 RNA (gRNA) 或目标 RNA 基因座上的 gRNA-RNA 结合蛋白复合物引导内源性或外源性脱氨酶介导 A-to-I 或 C-to-U 碱基转换,这是一种潜在的遗传疾病基因治疗方法。目前开发的 RNA 碱基编辑器广泛使用的脱氨酶是作用于 RNA的腺苷脱氨酶 (ADAR) ,包括 ADAR1 和 ADAR2,它们在哺乳动物细胞中的双链 RNA 的同源底物(如 GluR2 mRNA)上识别 A 并将其转化为 I。肌苷作为 ADAR 的催化产物,是腺苷的脱氨基形式,在 mRNA 翻译时被生化识别为鸟嘌呤。早在 1990 年代,科学家们就设计了人工反义寡核苷酸 (ASO),以招募内源性 ADAR,进而成功安装 A-to-I 编辑,以纠正非洲爪蟾胚胎中肌营养不良蛋白 RNA 的过早终止密码子突变,这与最近开发的三种方法相呼应,包括GluR-ADAR、RESTORE(为寡核苷酸介导的 RNA 编辑招募内源性 ADAR 到特定转录本)和 LEAPER(利用内源性 ADAR 对 RNA 进行可编程编辑)。然而,gRNA 介导的内源性 ADAR 募集强烈依赖于在编辑细胞中表达的 ADAR 家族成员的丰度和底物特异性。招募内源性 ADAR 还取决于有效创建和引入 ADAR 识别的外源 RNA 结构,这可能会干扰内源性 ADAR-RNA 调节网络。此外,该方法不能用于 C-to-U 和其他类型的 RNA 碱基编辑。用 AAV-PHP.eB 提供的 mxABE 在体内校正 Myo6C442Y 突变(图源自Science Translational Medicine )同时,通过分别用λ-噬菌体N蛋白和噬菌体MCP替换ADAR的内源性靶向结构域,进一步开发了内源性ADAR非依赖性RNA编辑系统λN-ADAR和MS2-MCP(MS2外壳蛋白)-ADAR。用于特定 λN 和 MCP 识别的同源发夹基序序列与引导序列融合,以实现定点 A-to-I 编辑。然而,对于 λN-ADAR 和 MS2-MCP-ADAR,需要考虑显著的脱靶编辑。最近,以 RNA 为靶点的 CRISPR-Cas13 系统被重新用于高效的 RNA 碱基编辑,例如 REPAIR(用于可编程 A 到 I 替换的 RNA 编辑)和 RESCUE(用于特定 C 到 U 交换的 RNA 编辑)技术,恢复多功能 RNA 编辑模式的发展。Myo6C442Y/+ 小鼠 AAV-mxABE 治疗后听力功能分析的图解工作流程(图源自Science Translational Medicine )REPAIR 和 RESCUE 已显示出通过 gRNA 编程的脱氨酶活性对培养细胞中的突变转录物进行纠正基因突变的能力。然而,由于 PspCas13b 和 ADAR 蛋白的大尺寸特性,它们不适合使用单个腺相关病毒 (AAV) 载体进行体内递送。因此,从紧凑型 Cas13 蛋白衍生的迷你碱基编辑器被开发出来,并在 A-to-I 和 C-to-U 替换方面表现出高靶向和低脱靶效率。由于其紧凑的尺寸,迷你碱基编辑器 [基于 dCas13X 的迷你腺嘌呤碱基编辑器 (mxABE)] 提供了通过单个 AAV 载体在体内治疗遗传疾病的潜力。尽管 λN-ADAR 和 MS2-MCP-ADAR 的体内应用在恢复正常蛋白表达方面显示出有希望的编辑功效,但没有观察到明确的治疗效果。因此,RNA 编辑工具的体内治疗有效性仍未在疾病模型中进行大量研究,以了解 RNA 编辑功效和疾病相关症状的治疗改善。肌球蛋白 VI (MYO6) 是一种非常规的肌球蛋白,锚定在耳蜗毛细胞的静纤毛和前庭板上,对听觉功能至关重要。人类 MYO6 基因的致病性变异导致常染色体显性或隐性形式的听力损失,潜在治疗需求未得到满足。建立了 Myo6C442Y/+ 小鼠模型,并概括了人类显性遗传性耳聋的表型。在这项研究中,发现将靶向 Myo6C442Y RNA 的 AAV-PHP.eB-mxABE 注射到新生 Myo6C442Y/+ 小鼠的耳蜗中可显著减少进行性听力损失。总之,该研究结果支持将这种治疗策略用于半显性疾病和潜在的隐性疾病。https://www.science.org/doi/10.1126/scitranslmed.abn0449